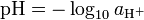OPINPOLKU 4.
tietoa adsorptiosta, ja sekoituksesta
https://fi.wikipedia.org/wiki/Absorptio_(kemia)
https://fi.wikipedia.org/wiki/Etikkahappo
työ aloitettiin tutustumalla ohjeisiin ja menetelmiin, oista kaikkia kaavoja ei ole saatu vielään sisäistettyä.
NaOH:ta oli jäänyt edellisestä työstä joten aloitimme suoraan etikkahapon laimentamisesta.
Hiilijauheen murskaus ja punnitseminen 6 kpl erlenmeyer pulloja.
välineet löytyivät tällä kertaa suhteellisen helposti. vaan melkein jokainen työväline oli likainen, ensimmäinen 20 min meni pesu hommiin, toisen parin sillä välin huhmareella murskatessa ja punnitessa hiiltä (C) kolmeen punnitusalustaan.
ionivettä laitettiin 6 erkka pullloon seuraavasti
48 ml 2.47.5 ml 3. 47 ml 4. 46.5 ml 5. 44 ml 6.40 ml
seuraavaksi laitettiin etikkahappoa 0,25 mol 6 pulloon
2 ml 2. 2,5 ml 3. 3 ml 4. 3,5 ml 5. 6 ml 6. 10 ml
ravistelijalla 30 min ajan
seuraavaksi suodatimme liuoksen buschner suppilolla ja otamme 20 ml x2 näytteet titrausta varten,
c1 * v1 = c2 * v2
v1 jaettuna halutulla moolimäärällä esim 0,1 mol/L kerrotaan halutulla tilavuudella ja jaetaan moolimassalla M/g.
vaihda suodatinpaperi joka kerta. varo kontaminaatiota. aloita mahd. mukaan laimeimmasta näytteestä suodatus.
muista absordion jälkeinen massa x/m
työvälineet:
Hioksella varustettuja erlenmeyrkolveja + korkki 100 ml
Byretti
Pipettejä
Ravistelija
Hiilijauhe
Etikkahappo
Natriumhydroksidiliuos, 0,1M ja 0,02 M
Fenoliftaleiini
ilmeisesti hiilijauhe ei ollut tarpeeksi hienoa koska pinta-ala ei ollut kovin suuri "S"
Laskukaavoja ei olisi ymmärtänyt kirveelläkään ellei olisi pidetty labrapäivänä kattava selvitys laskuista. pari kuvaa tässä