https://fi.wikipedia.org/wiki/Ester%C3%B6inti
Karboksyylihappojen, happoanhydridien ja happokloridien esteröinti
Yksi yleisimpiä esteröintireaktioita on niin kutsuttu Fischer-esteröinti, joka kuuluu
kondensaatioreaktioihin. Siinä karboksyylihappo reagoi
alkoholin tai fenolin kanssa muodostaen esterin. Katalyyttinä käytetään usein happoja, kuten
rikkihappoa,
p-tolueenisulfonihappoa, happamia ioninvaihtohartseja tai
Lewis-happoja. Katalyytteinä voidaan käyttää myös dehydraavia yhdisteitä, kuten
disykloheksyylikarbodi-imidiä. Reaktion
reaktiomekanisminensimmäisessä vaiheessa happokatalyytti protonoi karboksyyliryhmän karbonyylihapen, mikä tekee siitä
elektrofiilisemman.
Nukleofiilinen alkoholi reagoi karbonyyliryhmän kanssa nukleofiilisella additiolla ja muodostuu tetraedrimäinen välivaihe. Tämä välivaihe muuntuu molekyylinsisäisten protoninsiirtojen seurauksena toiseksi tetraedrimäiseksivälivaiheeksi, jonka hydroksyyliryhmävastaanottaa protonin. Tällöin hydroksyyliryhmästä tulee parempi
lähtevä ryhmä ja se irtoaa vetenä ja muodostuu esteri.Fischer-esteröinnin ongelmana on se, että se on
tasapainoreaktio, minkä vuoksi hyvien saantojen saavuttamiseksi tulee käyttää toista lähtöainetta ylimäärin tai poistaa tuotteena muodostuvaa esteriä tislaamalla tai poistaa vettä atseotrooppisella tislauksella. Veden poistoon voidaan käyttää myös
molekyyliseuloja.
[1][2][3][4][5] Fischer-esteröinti on usein hidas reaktio, jota voidaan nopeuttaa käyttämällä mikroaaltoasäteilytystä lämmitysmenetelmänä.
[6]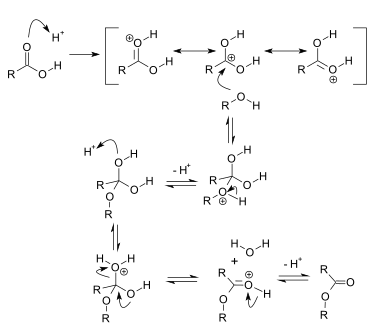
Alkoholit reagoivat myös
happoanhydridien ja
happokloridien kanssa muodostaen estereitä. Anhydridit ja happokloridit ovat karboksyylihappoja reaktiivisempia ja tällöin reaktio on usein nopeampi verrattuna Fischer-esteröintiin. Happokloridit ja happoanhydridit ovat tärkeitä erityisesti, jos karboksyylihappo on muuten liian vaikeasti reagoiva, ja niitä käytetään erityisesti steroidien esteröinnissä. Näissä reaktioissa käytetään nukleofiilisena katalyyttinä usein joko
pyridiiniä tai
4-dimetyyliaminopyridiiniä eli DMAP:ia.
[1][2][4][5]
Vaihtoesteröinnissä eli transesteröinnissä esterit reagoivat kuumennettaessa alkoholien kanssa muodostaen uuden esterin ja alkoholin. Tätä reaktiota katalysoivat niin hapot, emäkset kuin siirtymämetallitkin. Käytettyjä katalyyttejä ovat muun muassa rikkihappo, ioninvaihtohartsit ja
DBU eli 1,8-diatsabisyklo[5.4.0]undek-7-eeni. Mekanismiltaan vaihtoesteröinti muistuttaa esterihydrolyysin mekanismia.
[3][4][5]

Karboksyylihappojen alkylointi
Kolmas tapa valmistaa esteröinti on karboksyylihappojen alkylointi käyttäen alkyylihalogenidia tai jotain muuta alkyloivaa yhdistettä, kuten
dimetyylikarbonaattia. Reaktio vaattii emäskatalyytin ja usein katalyyttinä käytetään DBU:ta tai natriumvetykarbonaattia tetra-alkyyliammoniumsuolan läsnäollessa. Tetra-ammoniumsuola toimii tässä tapauksessa
faasinsiirtokatalyyttinä.
[4]
Puhdas
vesi on yksi
maailmankaikkeuden monipuolisimpia sekä yleisimmin esiintyviä liuottimia. Se pystyy liuottamaan esimerkiksi mineraaleja kalkkikivestä ja muodostamaan luoliin
tippukiviä.
Kemiassa liuotin-sanaa käytetään yleensä lähinnä
tapahtumaympäristönä, ei reagoivana aineena. Esimerkiksi
suolan liukeneminen veteen tuottaa suola
liuoksen, mutta
kuparin liukeneminen
typpihappoon ei tarkalleen ottaen tuota "kupariliuosta", vaan
kuparisuolaa liuottimessa. Monet kuparisuolat liukenisivat aivan yhtä hyvin veteen, joten liuotin sattuu vain olemaan happo. Kaikki
korroosiota aiheuttavat aineet eivät välttämättä liuota syöpyvää ainetta. Esimerkiksi happipitoinen vesitippa ei liuota
rautaa, mutta
ruostuttaa sen kyllä. Siksi on eroteltava se prosessi, kun aine korrodoituu, ja se prosessi, kun se liukenee.
Liuotin pystyy murtamaan aineen sisäiset sidokset, jolloin itse liuotinmolekyylit menevät liuotettavan aineen molekyylien väliin. Vastaavasti liuottimen omien sisäisten sidosten täytyy olla niin heikkoja, että liuotettava aine pystyy särkemään ne ja menemään väliin. Jos tämä ei onnistu, aine ei liukene. Esimerkiksi
sokeri ei liukene
bensiiniin, koska sokerin sisäiset voimat ovat "vetisiä"
vetysidoksia, joita bensiinin sisäiset
van der Waalsin voimat eivät pysty särkemään. Vastaavasti
PE-muovi ei liukene veteen, koska veden sisäiset sidokset ovat niin voimakkaita, etteivät muovin heikot van der Waalsin voimat pysty rikkomaan niitä.
Liuottimien jaottelu
Liuottimet voidaan jakaa
Proottisissa liuottimissa on ionisoituva vety, aproottisissa ei ole.
Puhdas
vesi on yksi
maailmankaikkeuden monipuolisimpia sekä yleisimmin esiintyviä liuottimia. Se pystyy liuottamaan esimerkiksi mineraaleja kalkkikivestä ja muodostamaan luoliin
tippukiviä.
Kemiassa liuotin-sanaa käytetään yleensä lähinnä
tapahtumaympäristönä, ei reagoivana aineena. Esimerkiksi
suolan liukeneminen veteen tuottaa suola
liuoksen, mutta
kuparin liukeneminen
typpihappoon ei tarkalleen ottaen tuota "kupariliuosta", vaan
kuparisuolaa liuottimessa. Monet kuparisuolat liukenisivat aivan yhtä hyvin veteen, joten liuotin sattuu vain olemaan happo. Kaikki
korroosiota aiheuttavat aineet eivät välttämättä liuota syöpyvää ainetta. Esimerkiksi happipitoinen vesitippa ei liuota
rautaa, mutta
ruostuttaa sen kyllä. Siksi on eroteltava se prosessi, kun aine korrodoituu, ja se prosessi, kun se liukenee.
Liuotin pystyy murtamaan aineen sisäiset sidokset, jolloin itse liuotinmolekyylit menevät liuotettavan aineen molekyylien väliin. Vastaavasti liuottimen omien sisäisten sidosten täytyy olla niin heikkoja, että liuotettava aine pystyy särkemään ne ja menemään väliin. Jos tämä ei onnistu, aine ei liukene. Esimerkiksi
sokeri ei liukene
bensiiniin, koska sokerin sisäiset voimat ovat "vetisiä"
vetysidoksia, joita bensiinin sisäiset
van der Waalsin voimat eivät pysty särkemään. Vastaavasti
PE-muovi ei liukene veteen, koska veden sisäiset sidokset ovat niin voimakkaita, etteivät muovin heikot van der Waalsin voimat pysty rikkomaan niitä.
Liuottimien jaottelu
Liuottimet voidaan jakaa
Proottisissa liuottimissa on ionisoituva vety, aproottisissa ei ole.
https://fi.wikipedia.org/wiki/Kiteytt%C3%A4minen
iteyttämisellä tai
kiteytyksellä (joskus myös
kristallisoinnilla) tarkoitetaan jonkin aineen saattamista
kiteiseen muotoon. Kiteisellä muodolla tarkoitetaan tässä yhteydessä usein vielä yksittäiskidettä, jossa kappaleen kaikki
atomit tai
molekyylit kuuluvat yhteen ainoaan kidehilaan. Kiteytetyn aineen rakennetta voidaan tutkia korkealla resoluutiolla (usein atomitasolla) kristallografian (erityisesti
röntgenkristallografian) menetelmin.
Kiteyttämisellä saadaan epäpuhtaudet jäämään liuottimeen. Aine liuotetaan sopivaan liuottimeen tai niiden seokseen. Liuosta jäähdytetään, jolloin aineen liukoisuus pienenee ja voidaan myös lisätä pieni kide ainetta, jonka halutaan kiteytyvän. Sitten odotetaan. Liuoksessa alkaa vähän kerrassaan muodostua kiteitä, jotka lopuksi suodatetaan liuoksesta erilleen. Jos halutaan erittäin puhdasta ainetta, on kiteyttäminen tehtävä muutamia kertoja uudestaan.
https://fi.wikipedia.org/wiki/Suodatus
Suodatusta käytetään
kemiassa erottamaan
liuoksesta epäpuhtauksia tai erottamaan aineet toisistaan.
Suodatus voidaan suorittaa käyttämällä
Büchnersuppiloa. Büchner-suppiloon laitetaan sopiva suodatinpaperi, liuos suodatetaan sen läpi imussa.
Myös tavallinen
suppilo soveltuu suodatukseen. Siihen voidaan laittaa suodatinpaperi, jonka läpi nesteen annetaan valua. Suodatinpaperin asemasta voidaan käyttää myös pumpulia.
Mikäli kiinteä aine ei liukene nesteeseen, muodostuu heterogeeninen seos, josta liukenematon aine voidaan erottaa suodattamalla.
Suodatuksessa hyödynnetään hiukkasten kokoeroja.
Reaktio on seuraava:
salisyylihappo asetanhydridi asetosalisyylihappo etikkahappo
Salisyylihappo on fenolihappo, joka sisältää bentseenirenkaaseen kiinnittyneen karboksyyliryhmän ja fenoleille tunnusomaisen hydroksidiryhmän. Salisyylihappo esteröityy tässä reaktiossa asetanhydridin eli etaanihappoanhydridin avulla. Katalyyttinä käytetään rikkihappoa. Reaktio ei onnistu vesiliuoksessa, joten lähtöaineiden on oltava kuivia.









































