OPINPOLKU 2.
Raportti opinpolku 2
Vichyveden Ca-pitoisuus, pH ja sähkönjohtokyky ennen ja jälkeen tislausta
tislaus: https://fi.wikipedia.org/wiki/Tislaus
http://www.kaiko.fi/fi/teollisuuden-tuotteet/1/tislaimet
http://www.ytm.fi/tuotteet/prosessitekniikka/liuotinten-tislauslaitteet-ist-italia-sistemi-tecnologic/
Tislaus on toisiinsa liuenneiden aineiden erottamiseksi käytetty menetelmä, joka perustuu seoksessa olevien aineiden eri haihtuvuuksiin. Tislaus on kemiantekniikassa yksikköoperaatio eli siinä ei tapahdu kemiallista reaktiota.
Tislaamalla saadaan erotetuksi toisiinsa liuenneet nestemäiset aineet sekä haihtumattomat aineet haihtuvista aineista. Tislauksen tuotetta kutsutaan tisleeksi ja haihtumatonta osaa pohjatuotteeksi tai jatkuvatoimisessa tislaimessa alitteeksi. Tislaus on monimutkaisempi versio haihduttamisesta, jossa haihtumattomat aineet erotetaan haihtuvista.Tislaus on energiaa runsaasti kuluttava prosessi, mutta siitä huolimatta tislausta käytetään paljon teollisuudessa.
https://fi.wikipedia.org/wiki/Happamuus
happamuus:Happamuus kuvaa positiivisten vetyionien (H+) (protonien) aktiivisuutta liuoksessa. Vesiliuoksen happamuus ilmoitetaan tavallisesti logaritmisella pH-asteikolla, jonka otti käyttöön Søren Peter Lauritz Sørensen vuonna 1909. Lyhenteessä pH[1] kirjain p eli potenz on saksaa ja tarkoittaa vahvuutta, ja H tarkoittaa vetyionia (H+). Toisinaan lyhenteen sanotaan tulevan latinan sanoista pondus hydrogenii[1] eli vedyn potentiaali. Happamuus voidaan ilmoittaa niin happamalle kuin emäksisellekin liuokselle.
tislaus laitteisto kuvassa. huom. yhdestä osasta puhallettu tislausiltahappamuus:Happamuus kuvaa positiivisten vetyionien (H+) (protonien) aktiivisuutta liuoksessa. Vesiliuoksen happamuus ilmoitetaan tavallisesti logaritmisella pH-asteikolla, jonka otti käyttöön Søren Peter Lauritz Sørensen vuonna 1909. Lyhenteessä pH[1] kirjain p eli potenz on saksaa ja tarkoittaa vahvuutta, ja H tarkoittaa vetyionia (H+). Toisinaan lyhenteen sanotaan tulevan latinan sanoista pondus hydrogenii[1] eli vedyn potentiaali. Happamuus voidaan ilmoittaa niin happamalle kuin emäksisellekin liuokselle.
- pH-arvo määritellään seuraavasti
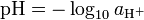
- kemiassa käytetty pH-asteikko on logaritminen asteikko.
- Aine voi olla hapan emäksinen tai neutraali
Sähkönjohtavuus
Sähkönjohtavuus eli konduktiivisuus (tarkemmin sanottuna ominaissähkönjohtavuus tai ominaiskonduktanssi, tunnus σ tai γ) on resistiivisyyden käänteisarvo. Englanninkielenomaisesti puhutaan myös konduktiviteetista. Aineen ominaissähkönjohtavuudenSI-järjestelmän mukainen perusyksikkö on 1/(Ω·m), jonka johdannaisyksikkö on S/m, siemensiä / metri."Sähkönjohtavuudella" viitataan toisinaan myös konduktanssiin (tunnus G), joka on resistanssin käänteisarvo.Teollisuudessa usein käytetty sähkönjohtavuuden yksikkö on %I.A.C.S (International annealed copper standard). Kun standardi määritettiin, valittiin puhtaan kuparin johtavuuden arvoksi 100 %I.A.C.S. Valmistus- ja raffinointimenetelmien kehittymisen ansiosta parhaiden kuparilaatujen johtavuus on nykyään noin 102 %I.A.C.S.- https://fi.wikipedia.org/wiki/S%C3%A4hk%C3%B6njohtavuus
6.3. Konduktometria
PeruskäsitteetPeriaate
Konduktometriassa mitataan liuoksen sähkönjohtokyky. Mitä enemmän ioneja on liuoksessa, sitä paremmin liuos johtaa sähköä.
Soveltuvuus
Konduktometria soveltuu happo-emästitrauksen indikointiin, sillä H3O+-ionit ja OH--ionit johtavat hyvin sähköä. Liuoksen ollessa neutraali siinä on vain vähän näitä ioneja, joten liuoksen sähkönjohtokyky muuttuu mittaliuosta lisättäessä. Johtokyky pienenee lähestyttäessä titrauksen päätepistettä ja sen jälkeen johtokyky alkaa kasvaa.Konduktometria
Sähkökemiallista johtavuusmittausta käytetään liuosmaisten aineiden sähkönjohtavuuden eli konduktiivisuuden mittaamiseen. Mittausanturi sisältää kaksi metallilevyelektrodia, joiden välille kytketään sähkövirta. Anturi upotetaan näyteliuoksen siten, että elektrodit peittyvät kokonaan. Johtokykymittari kalibroidaan ennen mittausta KCl-liuoksella, jonka johtavuus tunnetaan tarkasti. Usein kalibrointiin käytetään 0,01 mol/l KCl-liuosta, jonka johtavuus on 1,413 mS/cm lämpötilassa 25 ºC.
Mittari mittaa elektrodien välistä vastusta eli resistanssia R. Vastuksen suuruuteen vaikuttaa elektrodien välissä olevan näytteen sähkönjohtavuus κ. Kaavan muodossa resistanssi r:
R = k / κ
jossa κ = liuoksen johtavuus eli konduktiivisuus (S / m)
k = kennon geometriaa kuvaava kennovakio = l / A
( l = elektrodien välinen etäisyys, A = elektrodin pinta-ala)
http://www03.edu.fi/oppimateriaalit/laboratorio/analyysimenetelmat_6-3_konduktometria.html
https://phet.colorado.edu/fi/simulation/acid-base-solutions
Aine laskut ja punnitus
Indikaattori jauhe
PH mittaus laitteistso
sähkönjohtokyky mittari
työ vaiheita: työ aloitettiin tislaamalla vichyä noin 70 ml erlenmeyer pulloon.
kasasimme tislaus välineet
+ lisäsimme kiehumakivet 5kpl kiviä
tislauksen käydessä siirryimme seuraavaan vaiheeseen
pipetoimme 50 ml vichyä 250 ml erlenmeyer pulloon ja lisäsimme NaOH 2.0 mol/l 2 ml
erlenmeyeriin lisäksi 2 min kuluttua laitoimme 0,2047 g indikaattori jauhetta (kalkonkarbosyylihappo) ja kaadoimme sen pulloon.
teimme edta liuosta 250 ml natriumsuolaa. seur. aloitimme titrauksen lisäämällä 50 ml byrettiin
edta liuosta (dinatriumsuola)
0,9306 g dinatriumsuolaa
titraus tehtiin 3 kertaa. ei tislattuun vichyyn teimme ph ja johtokyky mittauksen laskimme arvot.
tislattu vichyn ph arvo ja johtokyky mitattiin ja sen jälkeen ei ehditty aloittaa titrausta NaOH 1ml ja indikaattori ainetta 1,078 g niin aine muuttui heti siniseksi ilman titrausta dinatrium liuoksella
työn pohdintaa: saimme poistettua "Ca" tislauksessa kokonaan ja virheprosentti oli yllättävän pieni 4,208 % lisäksi monta raporttia yhtäaikaa kesken ei ainakaan selvennä tuloksien laskemista, joten paras tapa tehdä on 1 työ ja 1 raportti kerrallaan. mutta muistiinpanot vihkossa pelastivat opinpolku 2:sen raportin viimeistelyn.
työn pohdintaa: saimme poistettua "Ca" tislauksessa kokonaan ja virheprosentti oli yllättävän pieni 4,208 % lisäksi monta raporttia yhtäaikaa kesken ei ainakaan selvennä tuloksien laskemista, joten paras tapa tehdä on 1 työ ja 1 raportti kerrallaan. mutta muistiinpanot vihkossa pelastivat opinpolku 2:sen raportin viimeistelyn.

















